🌐 نظرة عامة حول حالات المادة
جدول المحتويات
نظرة عامة حول حالات المادة تشرح الخصائص الفيزيائية للمادة في حالاتها الأربع: الصلبة، السائلة، الغازية، والبلازمية، مع أمثلة عملية على التحولات بينها مثل الانصهار والتبخر والتسامي، مما يساعد على فهم طبيعة المادة وسلوكها في الكون.
🔬 تعريف المادة
- المادة هي كل ما له كتلة ويشغل حيزًا.
- تتكون من ذرات تضم بروتونات، نيوترونات، وإلكترونات.
- الذرات تتجمع لتشكل جزيئات، وهي أساس جميع المواد.
- تمتلك الذرات والجزيئات طاقة كامنة تُعرف بالطاقة الكيميائية.
🌍 حالات المادة الرئيسية
الإغريق القدماء حددوا ثلاث حالات رئيسية للمادة (صلبة، سائلة، غازية)، ثم أضاف العلم الحديث الحالة الرابعة وهي البلازما.
1. الحالة الصلبة
- الخصائص:
- شكل ثابت لا يتغير بتغير الإناء.
- حجم ثابت وكثافة عالية.
- جزيئاتها متقاربة جدًا، تتحرك اهتزازيًا في مواضعها.
- أمثلة: الخشب، المعادن، الحجر، الألماس، ملح الطعام.
2. الحالة السائلة
- الخصائص:
- شكل متغير حسب الإناء.
- حجم ثابت.
- غير قابلة للانضغاط بسهولة.
- جزيئاتها قريبة نسبيًا، لكنها تتحرك بحرية أكبر من الصلبة.
- أمثلة: الماء، الزيت، الزئبق (المعدن الوحيد السائل في درجة حرارة الغرفة).
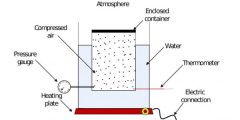
3. الحالة الغازية
- الخصائص:
- شكل وحجم متغيران.
- كثافة منخفضة جدًا.
- قابلة للانضغاط بسهولة.
- جزيئاتها متباعدة وتتحرك بسرعة في جميع الاتجاهات.
- أمثلة: الهواء، الأكسجين، الهيليوم.
4. الحالة البلازمية
- الخصائص:
- جسيمات مشحونة بطاقة عالية جدًا.
- أكثر حالات المادة شيوعًا في الكون.
- أمثلة: النجوم، الشمس، البرق.
📊 مقارنة بين الحالات الثلاث الأساسية
| الخاصية | الحالة الصلبة | الحالة السائلة | الحالة الغازية |
|---|---|---|---|
| الشكل | ثابت | متغير | متغير |
| الحجم | ثابت | ثابت | متغير |
| القابلية للانضغاط | ضعيفة جدًا | ضعيفة جدًا | عالية |
| الكثافة | عالية جدًا | عالية | منخفضة جدًا |
| قوى التجاذب | قوية جدًا | متوسطة | شبه معدومة |
| المسافة بين الجزيئات | شبه معدومة | متوسطة | كبيرة جدًا |
🔄 التحولات بين حالات المادة
المادة قادرة على الانتقال بين الحالات المختلفة نتيجة تغير الحرارة أو الضغط:
إقرأ أيضا:ما هي نترات الفضة- الانصهار (Melting): صلب → سائل.
- التجمّد (Freezing): سائل → صلب.
- التبخّر (Vaporization): سائل → غاز.
- التكاثف (Condensation): غاز → سائل.
- التسامي (Sublimation): صلب → غاز مباشرة.
- الترسيب (Deposition): غاز → صلب مباشرة.
مثال عملي: الماء
- عند 0°م يتحول إلى جليد (تجمّد).
- عند 100°م يتحول إلى بخار (تبخر).
- عند انخفاض الحرارة يعود البخار إلى ماء (تكاثف).
✅ خاتمة
إن حالات المادة تمثل الأساس لفهم طبيعة الكون وسلوك المواد في مختلف الظروف. من الصلبة ذات البنية البلورية، إلى السائلة ذات الحركة الحرة، إلى الغازية ذات الانتشار الكبير، وصولًا إلى البلازما التي تشكل النجوم، فإن دراسة هذه الحالات والتحولات بينها تساعد في تفسير الظواهر الطبيعية والتطبيقات الصناعية.
إقرأ أيضا:أين أجد كبريتات الباريوم